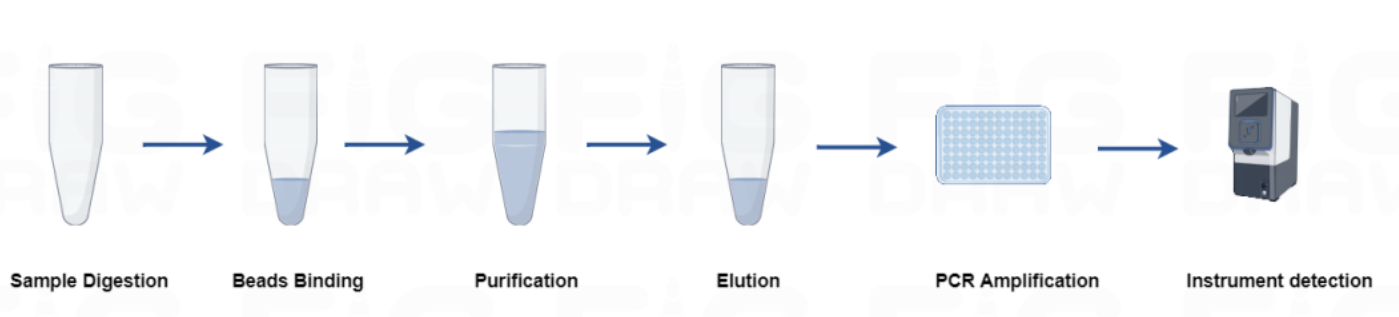
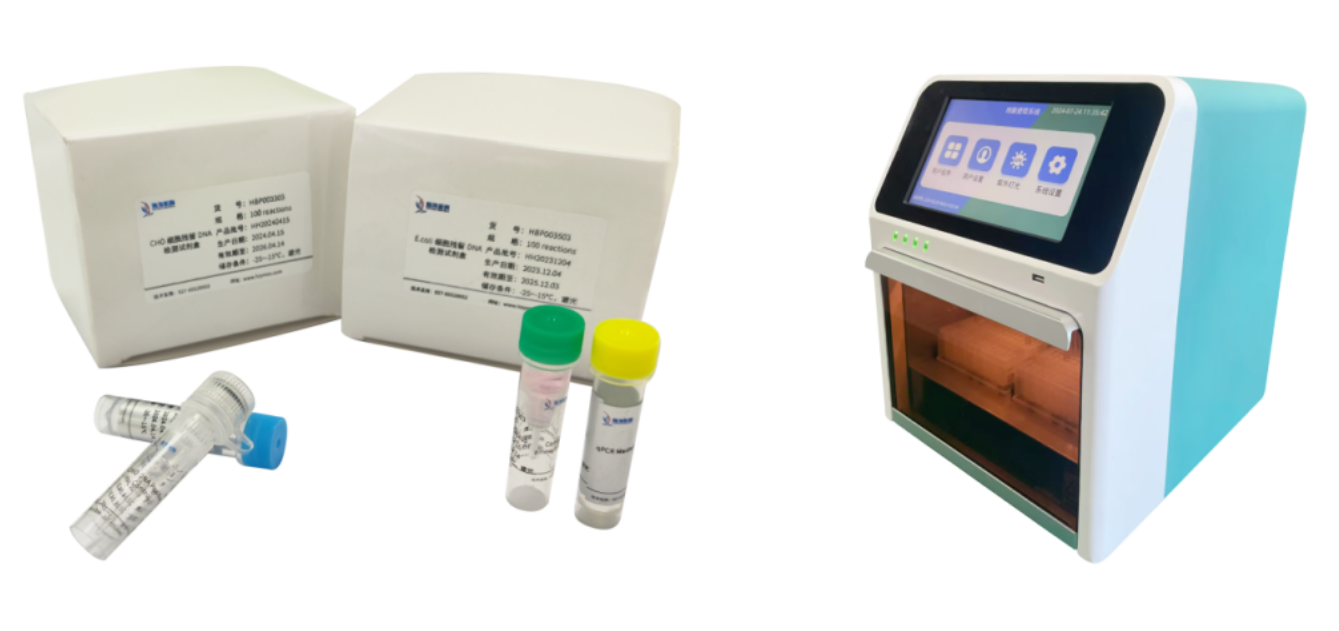
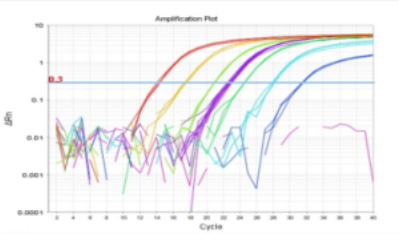
- 首页
- 走进瀚海
-
产品中心
-
-
-
-
过氧化物酶(POD)敬请期待,即将推出
-
-
-
-
-
-
脂蛋白脂酶(LPL)敬请期待,即将推出
-
甘油-3-磷酸氧化酶(G3PO)敬请期待,即将推出
-
-
-
-
-
-
-
-
-
-
-
葡萄糖氧化酶(GOD)敬请期待,即将推出
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
抗坏血酸氧化酶即将推出,敬请期待
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
- 技术服务
- 新闻资讯
- 加入我们
- 联系我们